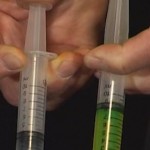
Prenons deux seringues dont l’extrémité est fermée hermétiquement. L’une contient de l’eau jusqu’à la moitié, l’autre reste vide et contient donc de l’air.Si l’on pousse le piston de chaque seringue, celui de la seringue vide s’enfonce facilement, tandis que l’autre reste immobile.
Fiche d’accompagnement de l’expérience:
 Matériel
Matériel-
2 seringues jetables neuves identiques
-
accessoires : briquet, pince plate
 Montage et réalisation
Montage et réalisationRemplir une première seringue jusqu’à la moitié avec de l’eau et une deuxième à l’identique avec de l’air.
Sceller hermétiquement les seringues en chauffant l’embout à aiguilles pour le ramollir et en l’écrasant aussitôt dans les mâchoires d’une pince plate.
Pousser le piston de chacune des seringues :
l’air se comprime alors que l’eau ne se comprime pas, même sous l’effet d’une pression importante (voir la figure).
 Explications
ExplicationsLa compressibilité d’un corps traduit sa variation relative de volume pour une augmentation de pression donnée.
La compressibilité isotherme s’écrit :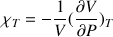
Dans un gaz, les distances entre les molécules sont grandes si bien que les interactions entre les molécules sont faibles. Pour comprimer un gaz, il suffit d’exercer une pression égale à celle qui résulte de l’agitation thermique. D’après l’équation d’état des gaz parfaits, le volume V d’une quantité d’air enfermé est, à température constante, inversement proportionnel à sa pression p :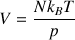
(N : nombre de molécules ; T : température ; 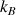 : constante de Boltzmann)
: constante de Boltzmann)
ce qui donne 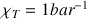 dans les conditions standard.
dans les conditions standard.
Pour comprimer un liquide, il faut surmonter des forces coulombiennes répulsives très grandes qui apparaissent lorsque les molécules sont à de faibles distances les unes des autres. C’est pour cette raison que la compressibilité de l’eau est très faible :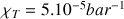 (pour T = 293 K et p de 1 à 25 bar).
(pour T = 293 K et p de 1 à 25 bar).
Si on double la pression dans la seringue à partir de la pression de 1 bar, le volume de l’air est divisé par 2 (compression isotherme) alors que la diminution relative du volume de l’eau calculée d’après la formule (1) n’est que :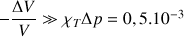
 Remarques
RemarquesPour un liquide, la diminution de volume n’est notable qu’à partir de pressions extrêmement élevées. Dans les mers, à une profondeur de 1000 m (pression d’environ 100 bar), la masse volumique de l’eau est supérieure de seulement 0,5% à celle de l’eau à la surface.