Du poivre fin saupoudré à la surface de l’eau est chassé par l’extension d’une couche superficielle de savon.
Fiche d’accompagnement de l’expérience:
 Matériel
Matériel-
une cuvette ou une assiette creuse remplie d’eau ;
-
du poivre fin, de la poudre de lycopode ou du talc ;du savon.
 Montage et réalisation
Montage et réalisationSaupoudrer un peu de poivre à la surface de l’eau d’une cuvette.
Plonger un doigt dans une solution d’eau savonneuse puis toucher l’eau au centre de la cuvette avec ce doigt : on voit le poivre « fuir » le centre à toute allure en dégageant à la surface de l’eau une étendue centrale sans poivre (voir la photo).
 Explications
ExplicationsLes molécules de savon sont amphiphiles : elles présentent une extrémité hydrophile (soluble dans l’eau) et une extrémité hydrophobe (non soluble dans l’eau).
Les molécules de savon déposées par le doigt restent à la surface de l’eau et forment une couche monomoléculaire constituée de molécules toutes orientées de la même façon : tête hydrophile dans l’eau et queue hydrophobe hors de l’eau.
Cette couche de molécules, en s’étendant sur la surface de l’eau, chasse instantanément le poivre qui flottait mettant ainsi en évidence l’étendue de celle-ci
La couche de savon à la surface de l’eau est grande comparée au faible volume de solution savonneuse apporté car les molécules de savon s’ordonnent en une couche de hauteur très faible puisque constituée par une seule molécule.
La flaque correspond donc à une sorte de champ de molécules de savon taillées en brosse.
L’épaisseur de la flaque précédemment obtenue n’est alors rien d’autre que la longueur d’une molécule (ou du moins, une valeur approchée…)
 Remarques
RemarquesL’expérience historique de Franklin
« L’esprit Benjamin Franklin »
Examinons ce qui se passe lorsqu’on ajoute à l’eau une petite quantité de « surfactant » (on peut considérer qu’une molécule d’huile entre dans cette catégorie). Les molécules de surfactant sont des objets assez extraordinaires ;elles sont plutôt petites (un à deux nanomètres de long) et possèdent deux propriétés violemment antagonistes.
Une des extrémités de la molécule est fortement hydrophile, nous l’appellerons « tête polaire » de la molécule. Le reste de la molécule est résolument hydrophobe, c’est une chaîne « aliphatique » formée d’atomes de carbone et d’hydrogène.
Si je plonge une telle molécule, seule dans l’eau, elle devient très « malheureuse ». Sa chaîne aliphatique ne songe qu’à fuir l’eau qu’elle exècre.
Aidée par l’agitation thermique, elle parvient à la surface. La situation, sans être idéale est déjà meilleure. La tête polaire peut rester immergée avec délice dans l’eau. La chaîne hydrophobe peut se sécher à l’air. En se serrant l’une contre l’autre comme les pingouins d’une rookerie, les molécules de surfactant peuvent alors créer une situation presque parfaite : tête dans l’eau, chaîne à l’air presque perpendiculaire à la surface. Les molécules forment une couche bien régulière dont l’épaisseur est égale à une longueur moléculaire. C’est une monocouche…
Depuis les Grecs, on sait qu’un film d’huile, répandu sur la mer, tend à calmer les vagues. Franklin, lui, fait l’expérience suivante : il va au bord d’un étang (à Clapham près de Londres, en 1774) et verse, doucement, une goutte d’huile d’olive sur l’étang d’environ 2 cm3). L’huile s’étale, la « peau » de l’eau est devenue comme rigide, c’est ce phénomène qui permet à Franklin d’évaluer assez bien la surface du film d’huile, elle est d’environ 2000 m² !
Texte adapté du livre de Pierre-Gilles de Gennes, Les Objets fragiles
La molécule d’huile ayant un pôle hydrophobe et un pôle hydrophile, une seule configuration lui permet de satisfaire ces deux propriétés : elle se place verticalement à la surface de l’huile, afin que sa partie hydrophobe s’éloigne le plus possible de la surface de l’eau. Les molécules d’huile ressemblent alors aux pingouins de la rookerie évoquée par Pierre-Gilles de Gennes, configuration dans laquelle ils se tiennent chaud.
D’après Franklin, une goutte de V = 2 cm3 conduit à une tache de S = 2 000 m². En supposant que la tache d’huile ait une forme cylindrique, nous pouvons simplifier la situation.
En effet, le volume d’un cylindre s’obtient en multipliant sa surface de base S par sa hauteur h, 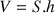
Dans notre problème, nous connaissons le volume V de la tache d’huile, qui correspond au volume d’huile versé, et sa surface S : nous pouvons donc en déduire l’épaisseur e du film d’huile 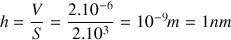
qui, comme nous l’avons remarqué plus haut, correspond également à l’ordre de grandeur de la taille d’une molécule d’huile !
L’image ci-dessous montre l’étang de Clapham avant et après y avoir déposé une goutte d’huile : observez le film d’huile, qui a comme propriété de « calmer » l’eau en rendant sa surface plus lisse et sans ondulations.
 Références
RéférencesL’expérience historique de Franklin

